文|氨基觀察
如果中國創新藥想在全球獲得成功,需要做好哪些準備?問題或許沒有標準答案。畢竟,不同的人有不同的認知。
但可以肯定的是,起碼要有一批覺醒者,帶領中國創新藥持續向前。而這,也正是中國創新藥產業在持續發生的。
我們不難發現,中國創新藥行業,已經歷經了多次蛻變。
第一個階段,是從上世紀末到2009年的綠林草莽期。那時候,天使投資大都是非專業投資人,在有遠見的政府的支持下,誕生了貝達醫藥、微芯生物等先行者;
第二個階段,是2010年到2014年的破局啟動期。頗具前瞻性的海歸們陸續回國,國內的投資們也開始加注。在fast follow策略的帶動下,百濟神州、君實生物們站上臺前;

第三個階段,是2015年至今的風云際會期。藥企們開始深切地感受到,創新才是發展的源泉,開始把目光放向全球,尋求國際化。由此,也誕生了傳奇生物等脫穎而出的新勢力。
中國創新藥產業一直在改天換地,這是屬于創新力量的“覺醒”。下一波創新浪潮正在趕來,中國創新藥行業也將邁向第四個階段。
在這一階段,將會出現兩類“全球新”的生力軍。一類是從基礎科研到新藥轉化的企業;另一類,則是技術瓶頸出發,以突破姿態引領全球發展的企業,例如細胞療法等產業。這些藥企的創新、國際化之旅注定更加波瀾壯闊。
覺醒在前,顛覆在后。當國內藥企不斷進化,牽引整個行業持續向上、立足全球,從望塵莫及到并駕齊驅,再到反超。
01 從望塵莫及到并駕齊驅
時間退回到5年前,上一次中國醫藥界的激情被點燃的時刻。
2018年12月17日,一則消息大力點燃了國內創新藥領域的投資信心:國內首個國產PD-1單抗獲批上市。
PD-1單抗是少有的明星抗癌產品。國產PD-1可以算作是中國醫藥產業騰飛的起點:在此之前,國內以仿制藥為主,創新藥幾乎全憑進口,患者的創新藥成本高;在此之后,創新藥類型層出不窮、蓬勃發展,中國和世界在新藥上市進度幾乎拉平,甚至趕超。
實現這一突破的本質原因,是過去幾十年國內醫藥創新力量不斷累積匯聚的結果。
2014年6月,世界上首款PD-1、美國百時美施貴寶公司生產的“歐迪沃”在日本獲批上市,引發了全世界的轟動。PD-1當時被成為“萬能抗癌藥”,不同以往的抗癌藥致力于殺死癌細胞,PD-1強化人體自身的免疫細胞,理論上對所有癌癥都有一定的抑制效果。
“歐迪沃”上市后,很快出現了競爭產品:美國默沙東公司的“可瑞達”。這也是一種PD-1,不過因為分子結構不同,“可瑞達”比“歐迪沃”對一些腫瘤的治療效果要更好。在短短幾年時間,默沙東的“可瑞達”就在銷售上實現了反超。2023年,“可瑞達”已經鐵定坐穩全球藥品銷售冠軍的寶座。
這件事情給了中國創新藥企業很大的啟發:只要方向正確,后來者也可以創造奇跡。
國外PD-1競逐風云的時候,中國企業內生動力也在逐步凝聚。十三五期間,生物藥物被列為我國產業重點發展的創新藥物品類,國家重大新藥創制等一系列政策鼓勵藥企投資研發,資金快速向生物制藥傾斜,國內初創的創新藥企如雨后春筍般快速冒頭。PD-1就是其中的代表。
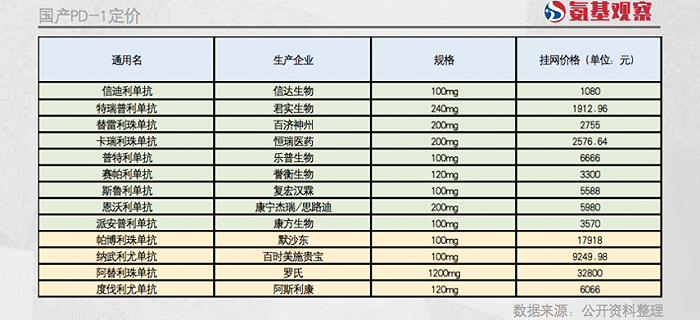
在國產PD-1獲批之前,中國市場上“歐迪沃”和“可瑞達”的價格驚人,年費用在50萬元以上,這和過去幾十年里,外資藥企控制高端藥品價格的操作是一模一樣的。
然而2019年以后,國產PD-1陸續獲批上市,療效比肩兩款進口藥,國內患者的藥物選擇大大增加。近5年時間里,國產的PD-1已經超過10種,大多數經過醫保部門的價格談判進入醫保。
質優價廉的國產PD-1目前年治療費用已經降到4萬元以下,而且還能享受近70%的醫保報銷。這對K藥、O藥等進口藥產生了明顯的觸動。盡管這些藥的掛網價依然堅挺,但目前基本都通過贈藥等方式優惠患者:K藥上市之初年治療費用在50萬元以上,如今治療一些癌種,患者實際支付的年費用只要7萬元左右。
國產創新藥促進了PD-1市場的空前繁榮,不但患者獲益,參與者們也都各得其所。這就是市場的魅力。
研發需要技術底氣,決策則需要激情和信仰。中國能出現PD-1遍地開花的景象,一方面是從2012年開始的內引外聯,敞開大門不斷積累來自全球前沿技術;另一方面,政策支持、技術給力,投資人能看到蓬勃的市場機會,對未來有期待有憧憬,才是更深層次的原因。
可以看到,自從國產PD-1藥物大批出現之后,中國成為國際普遍認可的、能與美國市場匹敵的新興創新藥市場。包括PD-1在內的不少國產創新藥物在美國開展臨床試驗、獲得批準上市,代表中國向全世界展現科技實力。
02 新關鍵節點與新機遇
PD-1是中國生物醫藥產業的突出代表。中國醫藥創新起步明顯晚于國外,并沒能在本世紀初趕上全球第一波創新藥研發浪潮。但在2010年之后,一些細分領域不但實現了與世界巨頭并駕齊驅,甚至引發跨國制藥企業的競爭憂慮,實際上是完成了產業突破的表現。
可以說,在第二波創新藥浪潮中,中國企業毫不示弱。
據統計,截至今年7月,國內累計批準創新藥品達130個、創新醫療器械217個,中國醫藥行業的創新動能越來越強。
更多先進療法不斷涌現,如在當下比較熱門的ADC領域,2021年便有榮昌生物的注射用維迪西妥單抗獲批上市;2022年科倫博泰的ADC品種還未上市,就以近百億元的授權費用拿到了跨國默沙東的投資;今年4月,啟德醫藥TROP2 ADC也授權給了美國的Pyramid生物醫藥公司。
ADC作為一類創新藥的代表,中國企業已經基本實現和跨國巨頭的并跑。在更前沿的領域,國產的創新品種更是有超越的可能。
以CGT為代表的第三波浪潮中中國企業就沖到了世界前排。2022年2月底,傳奇生物的西達基奧倫塞獲得FDA批準在美國上市,代表中國CAR-T正式進軍全球新藥最多的美國市場。今年上半年,傳奇生物的這款BCMA CAR-T銷售額達到1.17億美元,同比增長388%,儼然成為美國一線CAR-T產品。
目前,國內已經有兩款CAR-T產品上市,分別是復星凱特的“奕凱達”和藥明巨諾的“倍諾達”。新的CAR-T療法還在層出不窮。今年7月,信達生物和馴鹿生物聯合開發的國內第三款 CAR-T療法獲批上市,確定為116.6萬元一針,低于前兩款CAR-T。
監管機構加快創新藥物的上市評判,使得CAR-T產品價格出現松動,這和當年PD-1的競爭格局是類似的。曾經被外國制藥巨頭壟斷的技術,隨著中國入局者增多,“神藥”距離患者越來越近,這一方面表明中國生物醫藥技術發展之勢不可阻擋,另一方面也不斷印證著產業從高端稀有到人人可及的客觀規律。
如果沒有行業參與者的共同努力,CAR-T的前景不會那么快被發掘出來;如果不是政策和產業兩兩呼應,CAR-T不可能快速讓更多患者獲益。
據不完全統計,目前正在開展確證性臨床試驗的CAR-T至少在5款以上,其中,傳奇生物的BCMA CAR-T、科濟藥業的CLDN18.2 CAR-T、合源生物的CD19 CAR-T已經申報上市;恒潤達生的CD19 、亙喜生物的CD19/BCMA雙靶點等CAR-T產品有望很快進入到NDA階段。
一項新技術的導入,一定會經歷突破技術瓶頸、競品涌現、衡量優勢、優勝劣汰等過程,全行業對新技術的認知才會不斷深化,對賽道的評估才會更加理性,對風險才會更有深的理解,技術對社會才能體現出更大的價值。
這個過程需要社會、政策、資金足夠的時間和耐心。尤其是創新藥領域,業內普遍認同“雙十定律”(即研發一款新藥的平均時間是十年,花費十億美金),已然說明了創新藥發展前進的曲折性。
以CAR-T為代表的細胞和基因治療領域一定是未來生物醫藥皇冠上的明珠。國家層面,8月13日國務院印發的《進一步優化外商投資環境,加大吸引外商投資力度的意見》就明確指出:鼓勵外商投資企業依法在境內開展境外已上市細胞和基因治療藥品臨床試驗。
細胞和基因治療行業如今正處在導入期。只有當企業面對的環境越來越寬容,持續性創新才能成為全行業共同的目標,中國藥企躋身全球頭部制藥企業也將不再遙遠。
生物醫藥行業韌性十足,經歷疫情考驗后,全行業變得成熟和務實。期待在這一賽道奔跑的企業,迎來中國新一輪創新藥的發展高速期。



