文|氨基觀察
過去十年,創新醫療器械行業上演了一幕幕產業與資本的協奏曲:產業架橋、資本開路,共同創造了從無到有的奇跡,顛覆者層出不窮。
然而,資本市場的慷慨解囊,在推動創新的同時,也加速了行業內卷。許多國內企業在產品開發上,似乎都在遵循一種“差不多”的策略:
從立項之初,就未將超越現有技術作為目標;而是滿足于開發一些短期內能帶來財務回報的“勉強可用”產品。
雖然不能一概而論,但這一現象確實存在。無論是心臟瓣膜還是神經介入,這些看似高端的領域,也未能幸免于內卷的漩渦。
曾經的顛覆者,也難逃被顛覆的命運。市場預期的破滅,資本的退潮,導致企業估值的大幅縮水。

創新醫療器械行業,無疑需要一場深刻的供給側改革,扭轉這一頹勢。眼下,轉機或許已經出現。
最近,健世科技TTVR產品的上市遇阻,可能是供給側改革已經啟動的一個信號。企業們是否已經做好了準備,迎接這場改革的洗禮?
01 創新橋頭堡
在心臟瓣膜領域,經導管三尖瓣置換產品無疑是國產醫療器械創新的橋頭堡。
三尖瓣返流是由三尖瓣無法完全閉合引起的,會導致心臟收縮期血液從右心室倒流到右心房的情況。長期來看,三尖瓣返流會導致右側郁血性心力衰竭,癥狀包括外周水腫、腹水及郁血性肝病變。
在傳統的治療手段中,藥物與傳統外科三尖瓣介入是核心治療手段。但藥物相對來說起到控制的作用,且作用相對有限,因此手術是最后的補救手段。
但傳統的外科手術,由于侵入性太大,對老年人和高風險患者不大又好,因此需要更安全有效手術治療方式的面世。
在TAVR之后,包括愛德華等全球企業,也都瞄準了經導管三尖瓣介入修復/置換產品的研發。相對于傳統外科手術,經導管三尖瓣介入修復/置換產品在安全性方面擁有無可比擬的優勢。
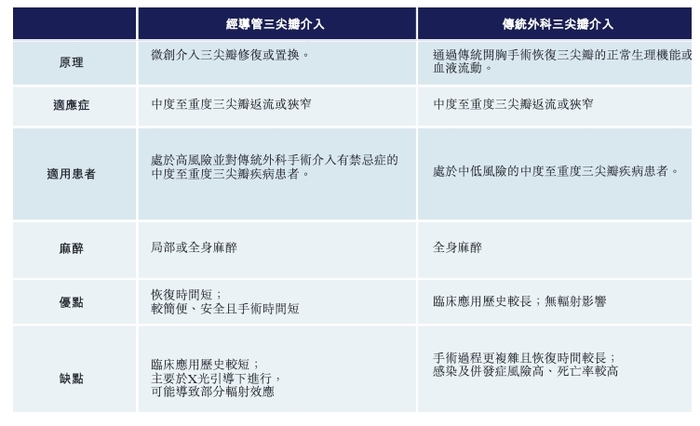
相比于大部分醫療創新產品,國內企業在經導管三尖瓣介入置換產品的研發上,走在全球前列。
健世科技的LuX-Valve,是世界上首個完成確證性臨床試驗受試者入組的在研產品,公司也是預期,其將成為全球首批獲批準用于商業化的經導管三尖瓣置換產品之一。
在招股書中,健世科技描繪了LuX-Valve的暢想圖:預計2023年將有600名患者接受經導管三尖瓣介入的收入治療,2030年將增長至20.09萬名。
也正是基于LuX-Valve的預期,健世科技完成了港股上市。當然,不管臨床上是否能夠完成患者數量激增的目標另說,LuX-Valve的首要任務是拿證上市。
遺憾的是,LuX-Valve上市的目標擱淺了。
02 倒在了審批環節
從臨床數據來看,LuX-Valve的性能確實給人留下深刻印象。
一年的隨訪數據顯示,有99.1%的患者三尖瓣返流情況得到了改善,94.4%的患者三尖瓣返流程度降低至輕度或更輕微,而75.7%的患者更是恢復到了無返流或微量返流的狀態。
在這一年的觀察期內,全因死亡率為10.32%;發生三度房室傳導阻滯或需要植入永久性起搏器的患者比例僅為1.6%,發生卒中的比例為2.4%,而肺梗塞和瓣膜支架斷裂的發生率均為0。
綜合這些數據,可以認為LuX-Valve在確證性臨床研究的一年期結果中表現出了卓越的療效和安全性,不僅顯著改善了患者的三尖瓣返流癥狀,還顯著提升了患者在術后的身體狀態和生活質量。
那么,LuX-Valve又為什么折戟呢?LuX-Valve的臨床試驗設計可能正是其遭遇挫折的關鍵所在。根據媒體報道,公司表示否決理由是,該類產品無法確認權威的單組目標值。
原來,該產品采用了單組目標值設計的臨床試驗,其主要評估終點是一年內的累計死亡率。據媒體報道,公司方面表示,遭到否決的理由是該類產品無法確立一個權威的單組目標值。
單組設計,也就是單組目標值試驗設計,指的是在試驗中只設立一個試驗組,而不設置對照組。通過連續納入符合條件的病例,并進行試驗器械的干預,來評估試驗器械的療效。然后將試驗器械的療效與預先設定的目標值進行比較,以此來評價試驗器械是否達到了預設的療效目標。
這種設計相對簡單,但由于缺少了同期對照組,單組試驗設計存在固有的偏倚風險,比如非同期對照偏倚,由于時間和空間上的不一致,可能會引起選擇偏倚、混雜偏倚、測量偏倚和評價偏倚等問題。
關于單組目標值設計,國家藥品監督管理局醫療器械技術審評中心曾明確指出,在臨床試驗設計中,隨機、設盲、平行對照的設計能夠提供更高等級的科學證據,應當被優先采用;而單組目標值設計只在特定條件下才會被考慮接受。這表明監管機構傾向于更有說服力的臨床試驗設計,以確保醫療器械的安全性和有效性。
LuX-Valve目前面臨的問題,最終導致了其遭到否決。如果確實如公司所說,問題出在臨床設計上,這或許反映了監管機構對于“單組目標值”設計的更加嚴格的要求。
03 LuX-Valve折戟啟示錄
當然,無論LuX-Valve是否因為臨床設計的問題而在審批環節遭遇挫折,這一事件都為我們帶來了重要的啟示。
在醫療器械領域,海外巨頭之所以能夠崛起,很大程度上得益于它們對技術創新的不懈追求和對產品質量的嚴格要求。巨頭們通過持續的研發投入,不斷推出具有突破性的產品,滿足了市場的高標準需求,從而贏得了市場的認可和尊重。
對于國內醫療器械企業來說,要想在競爭激烈的市場中立足,就必須在產品開發上做得更好。這意味著企業需要不斷追求技術上的突破,提高產品的創新性和競爭力;同時,也要在工藝上不斷精進,提升產品的性能和質量。
此外,在臨床試驗的設計和執行上,企業也應對自己提出更高的要求。臨床試驗是驗證醫療器械安全性和有效性的關鍵環節,其結果直接關系到產品的審批和上市。因此,企業應該選擇科學合理的臨床對照產品,確保臨床試驗的嚴謹性和科學性,以高質量的臨床數據支撐產品的審批。
只有持續挑戰更高的目標,不斷推動產品的創新和優化,企業才能推出更高質量的產品,從而在激烈的市場競爭中避免被顛覆。
換言之,對于國內創新醫療器械行業來說,供給側改革不應僅僅是政策層面的推動,更應由企業自身發起,自我革命,這才是“內卷”該有的樣子。



