文|財健道 張羽岐
編輯|尹莉娜
中藥,正在成為整個醫藥產業最“火”的細分領域。
去年以來,包括《關于加快中醫藥特色發展的若干政策措施》等在內的一系列利好政策,將中藥股屢屢推上漲停潮(詳見《財健道》文章《創新藥淪陷時,中藥回潮》)。
國家醫保談判藥物經濟學測算專家組組長、北京大學國家發展研究院學術委員會主任、北大全球健康發展研究院院長劉國恩教授不久前在接受《財健道》專訪時談到,盡管中國有千年“國藥”基礎優勢,“但中成藥現代化方面,日本等多個國家都超越了我們”。尤其在傳統藥物成分的技術提煉、標準化、安全性、方便性和依從性方面,值得國內學習。
在日本,一份補中益氣湯,可以有14種,甚至幾十種方子,針對不同的適應癥,無論是藥品用法,還是不良反應,詳細程度可比西藥。
在細分與詳細之下,今天的漢方如果沒有經過細致化、精細化的檢驗,是無法出現在日本的貨架上和醫療機構中。
可是,中醫藥自公元5、6世紀被日本引入后,也一度經歷混沌發展的黑暗時期。直到20世紀70年代《一般用漢方處方指南》的發布,以及緊隨其后的GMP、臨床檢驗,專利等制度的規范和醫保扶持,才讓中藥在日本走上規范、合法的現代化發展之路,成為后來被廣泛認可的的“漢方藥”。
反觀中國,盡管康萊特注射液、連花清瘟膠囊、復方丹參滴丸、扶正化淤片、桂枝茯苓膠囊相繼在美國開展臨床試驗,但目前獲批的植物藥沒有一款是國內所產。而1998年,天士力(600535.SH)的復方丹參滴丸正式以藥品身份通過美國FDA的I期臨床研究(IND)申請,20余年過去,這一流程尚停留在臨床III期階段。天士力出海20年,仍未結得果實。
他山之石,可以攻玉。了解日本漢方的正本崛起之路,即以史為鑒,厘清國內中醫藥產業發展的現實困境與破局方向。
當我們從傳統醫學向現代醫學邁進,政策、市場都來了,頒布與落地能否同頻共振,我們與日本又能否“同工同曲”?或許可以先一睹漢方的過去與未來。
01、歷史的天空:“斬斷手腳”VS重燃的漢方制劑
20世紀70年代,《一般用漢方處方指南》出世,幾近絕跡80余年的日本漢方制劑重回“合法”地位。294種常用處方, 148種醫用漢方制劑是更迭后的最新數據。
漢方一度式微,與明治維新直接相關。1853年,美國海軍準將佩里“黑船開國”,打開了日本現代化的大門。15年后,明治維新啟幕,日本全面西化,由傳統轉身,擁抱現代文明,西醫為中心的醫療制度確立。到19世紀末,漢方醫學幾乎被全面禁止,瀕臨滅絕。
本來,日本傳統醫學的分類中有自歐洲傳來的“蘭方”(由荷蘭醫學引入)、獨有“和方”(本土)和早在5、6世紀就漸進由中國傳入日本的中藥方,即“漢方”。
當然,即便漢方與中醫藥一體同源,向其他古有的技術一樣自朝鮮半島傳入日本,但當分化到不同的國家,特色分野逐漸顯著。江戶時代中期,古方派出現,成為今日日本漢方的開端,也使“漢方”臨床醫學得以發展。然而延續并非那么容易,古方派的極端,重建、雜糅(蘭方)的過程中,人們也開始反思學派爭斗和臨床有效性到底何為第一位?
事實證明,臨床的有效性才是重要的,這一點在后來對漢方制劑的臨床檢驗中也再次佐證。
漢方制劑載于歷史,當然也要陪著大環境走一遭,是否認可、是否利好,正如現在國內的政策,受其裹挾,亦受其左右。如果江戶時代是其春秋少年時,那么明治維新就使它淪為末日黃花,一遭被踩死,想要復活恐怕要比草的生命更頑強些。
西醫向上,“漢方”向下,七巧板不是天秤,只能一邊在上,一邊在下。此后幾十年,“漢方”斷斷續續發展,保留漢醫申請被第八屆國會否決,猶如斬斷手腳,即便中途零星發展,沒有官方站臺,醫保保障,一切都是空談。
直到20世紀70年代,由厚生勞動省藥物局監制的《一般用漢方處方指南》重燃“漢方”希望。1976年,津村(日本)33種醫療用漢方制劑被納入醫保藥價標準更加持了對“漢方”的重視與認可。
此后,醫療用漢方制劑全部納入醫保、制定日本漢方生藥制劑協會"醫療用漢方浸膏制劑GMP"標準、日本東洋醫學會專家通過日本專業醫生學家認證組織認證,以及后續的產業化發展,都在訴說著漂洋過海到達日本的“漢方”并沒有從此銷聲匿跡,而是獨具特色的保留,并融入在日本醫療的血液中。
02、從研發到生產:產業化背后的細分邏輯
20世紀70年代,斷檔80年的漢方藥在重新獲得“合法身份”后,通過“官-產-學”的方式完成了漢方制劑從無序到有序的規范化、標準化過程。
根據日本官方的要求,漢方藥一共分為三類,即一般用漢方藥制劑(OTC)(共294個處方,基本上來自《傷寒論》及《金匱要略》等中國傳統醫學的經典著作)、藥局制劑漢方藥(共185個處方,主要認可作煎劑及散劑)、醫療用漢方制劑(共148個處方,根據醫師處方用于診療保險,并收載于《藥價基準》)。
一份補中益氣湯可以分裂成14張方子(甚至33張方子),并且詳細分成了醫療用和其他用處,適應癥點到點對號入座,何時服用,服用多少劑量都清楚的標出,幾乎與擁有復雜化學式的西藥產生同頻共振的效果。
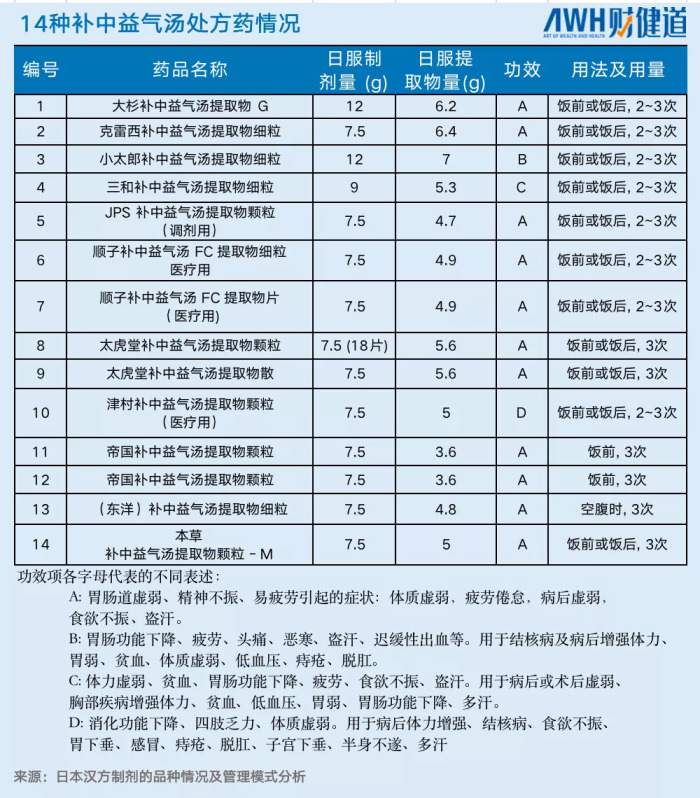
正如前面所說,盡管在外界看來148種醫用漢方制劑少之又少,但它更多的體現是“小而美”,漢方的精細化程度做到了極致。
在148張醫用漢方制劑中,經過PMDA官網查詢共有695份醫用制劑說明書,醫療漢方制劑的批文有約700個,集中的獲批時間在上世紀80年代左右,可以說在《一般漢方處方指南》出臺之后,各種政策也在相應的跟進。
審批、研發、生產、質量監管、銷售像是人的五官缺一不可,無論丟棄哪一個,都猶如自斷手腳。
1975年,日本又頒布了《一般用漢方制劑指南》,收錄了處方210張,且對每一張處方的配伍、用法、用量、功能主治做了嚴格的劃分和規定,成為漢方后續研發和生產的基礎,如果無法躍過此條,那么后續的生產和銷售也只是紙上談兵、夸夸其談了。(漢方目前審批依據為:藥審第804號通知《關于醫療用漢方制劑的受理規定》及藥審2號第120號通知《關于與標準湯劑進行比較實驗的資料》)
漢方醫學課程、生藥研究部、官方中藥研究所、民間中醫藥研究會、藥企,無論是官方還是民間,對于漢方研發的投入都不在少數。據最新數據統計,僅研發人員就占比近3萬人,而在日本漢方銷售Top10的藥企中,平均研發費用從2002年的588億日元增至2010年的1262億日元。而作為日本漢方的龍頭大哥-津村藥業(日本三大漢方企業:三共、津村、鐘紡)不僅在處方上占據優勢,在研究研發投入上,總體也呈現上升趨勢,僅研究研發費率就約為5%,而新藥研發投入也占每年銷售收入的10%-20%左右。
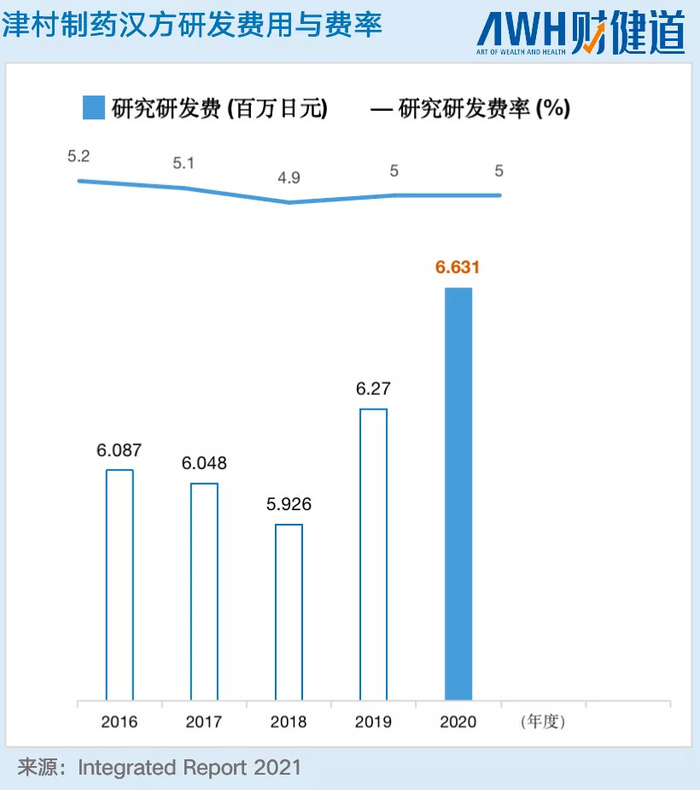
而在國內,在2021年前三季度,著名的云南白藥,——盡管營收近300億元,研發占營收比僅為0.69%。與創新藥企的高研發相比,中藥企業九牛一毛的研發占比備受市場詬病。
當然只研發,單投入,如同只做鞋,而不檢查鞋子到底好不好穿。如果不好穿,就去銷售,前期的投入或許就白費了。
漢方能夠廣泛受到認可,就在于有一套完整的質量檢測標準。1976年,日本頒布《藥品生產質量管理規范》(GMP);2003年再次頒布《藥用植物種植管理規范》;2012年頒布《生藥及漢方生藥制劑制造與品質管理相關基準》,自草藥在土里時或培育階段就開始進行嚴格的篩選,對草藥的鑒別、含量的測定等進行全方位的檢測,尤其是“凡是在日本藥局方中明確規定成分含量的藥材,在漢方制劑中必須符合,且要求測定指標的成分不少于3種”。
好的草藥從“出生”就被選中,而無法通過篩選的草藥,就再也無法納入標準制藥中。當然如果確實無法鑒定的,就需要實驗數據加以證明,量化為第一要義。化學一致性使得其通過藥材的種植、來源以及古籍出處先期評估,而不是“我覺得是”,或“古書覺得是”就能采納。
當然嚴苛也不只如此,GMP、化學一致性只是一面,另一面是它的生物等效性。漢方恢復“合法”地位后,比照西藥的EBM(雙盲對照,隨機分組,多中心觀察)原則也開始在漢方中實施,臨床功效不是說可以就可以,能夠記載的每一個漢方都一一進行確認,確認其臨床功效如何,安全性如何,并且生產廠家要提供漢方制劑(成品)、浸膏(半成品)與標準湯劑進行統一性比較的資料,用以做下一步一致性的驗證。
或許在漢方制劑能夠立足國內以及世界的背后,是其缺一不可的“五官”,好不好看不重要,重要的是將每一個器官都物盡其用。
03、從OTC到醫療制劑,漢方藥的產業化
從OTC到醫療制劑,漢方藥的藥產值在2014-2019年總產值在藥品總產值中占比穩中帶升,雖然2019年日本國內藥品總產值驟增,影響了漢方藥的占比,但仍占比1.88%。
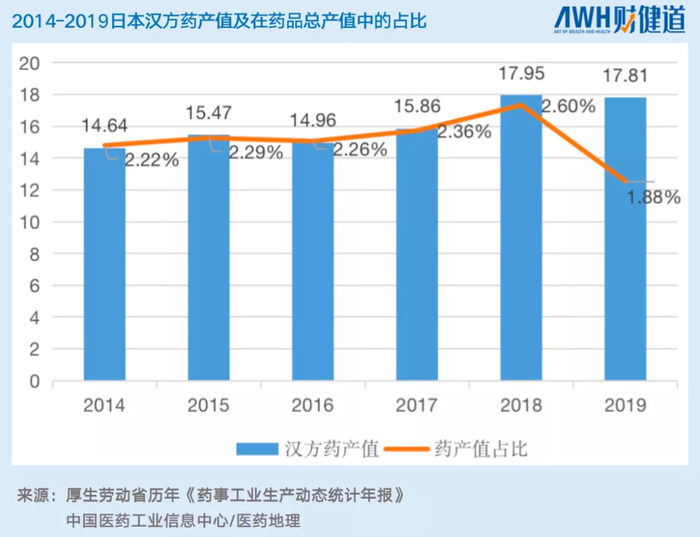
此外,據不完全統計,日本漢方藥廠目前約有200家,漢方藥制劑多達2000多種(藥品流入市場的種類)。一份對于日本醫生抽樣調查顯示,89%的日本醫生會選擇開具漢方藥處方。在日本6萬多家藥店中,80%以上都經營漢方制劑。
左手OTC,右手醫療漢方制劑。與醫療保險綁定,由醫生直接開出的醫療制劑或許更能突出漢方在日本的重要程度。
2020年,日本國內醫療用醫藥品市場約為10.3萬億日元(約合5600億人民幣), 其中,醫用中藥制劑為1610億日元(約合88.96億人民幣),市場占有率僅為1.6%,但相比2006年增長了超50%。
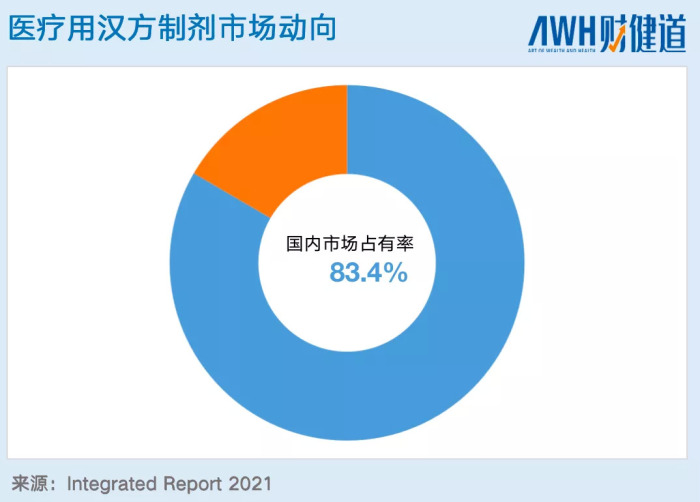
從整體的趨勢來看,2011-2020年,醫用漢方制劑的增長率從未停止,甚至超過了整個藥品市場。其中,在整個漢方制劑中最大的玩家甚至是唯一玩家就是津村藥業,僅醫療漢方制劑在國內市場就占比83.4%,從漢方在日本重燃之時,津村的地位就已經樹立。
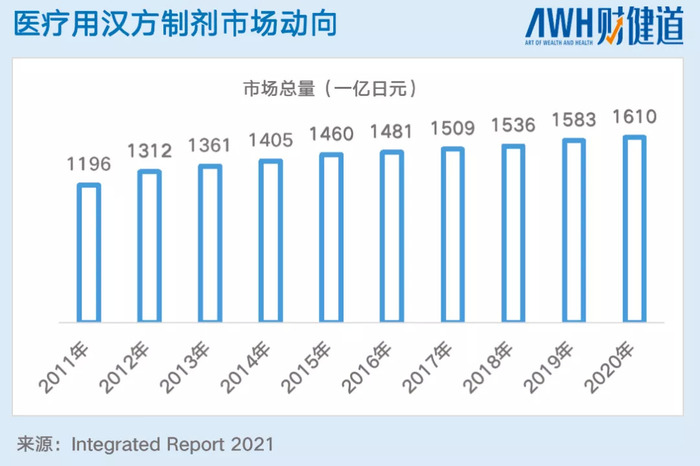
當然上文所提即指醫療用漢方制劑,但整體上而言漢方不僅有醫療制劑,還有OTC等。日本漢方的發展也不能僅靠“閉關鎖國”,醫保加持,國民認可是一部分,而另一部分是在國際上廣泛的受到認可,日本厚生勞動省2019年數據顯示,在漢方出口額中,中國大陸、中國臺灣、瑞士、美國、韓國等國家或地區是漢方出口占比最大的五個地區。僅中、瑞、美等地出口金額就占比漢方出口總數的近80%。
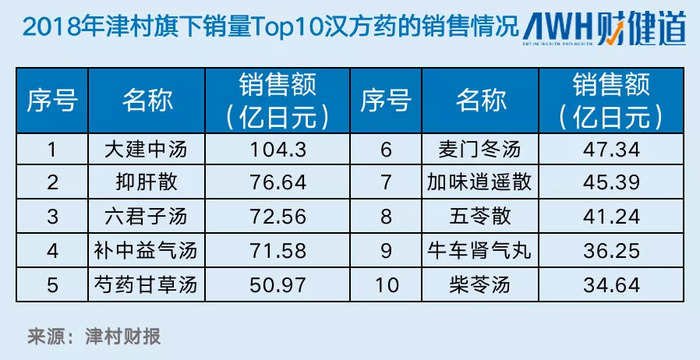
以2018年津村旗下的漢方銷售情況為例,全年凈銷售額約為1200億日元(約合75億人民幣),處方藥使用在漢方制劑更達95.3%。不僅在海內占據一席之地,海外拓展也在積極拓展,大建中湯、抑肝散、補中益氣湯、六君子湯等十大暢銷藥銷往美國、歐洲、韓國、東南亞以及中國臺灣、中國香港等地的市場。
當然藥品的出口也較為嚴格,如六君子湯在日本為第二類醫藥品,銷售過程中需要專業醫生或藥劑師指導(非強制),且需要面對面購買。(日本藥品包裝分類:第一類醫藥品、第二類藥品、第三類藥品、保健機能食品、健康輔助食品)。
值得注意的是,漢方制劑出口強勢的背后,與中國中藥材的供應必不可分。俗話說,藥材好,藥才好;道地藥材,療效最好。來自中國的生藥,作為漢方制劑的基礎原料,可以說是起到了決定性作用,其年使用總量約為2萬噸,中國是其最大的原料產地,占比約為83%,日本國內約為12%。其他國家引進約占5%。津村在中國設有自己的藥材企業,與150多家中國藥材供應商合作。
中國的相關出口亦在印證。相對于中成藥出口的弱勢(出口在整體藥品中出口額占比僅為6.75%),原料藥出口處于強勢地位。從2019年中藥類商品出口概況來看,中國作為原料藥大國,植物提取物、中藥材出口占比靠前,全球出口額分別為23.7億美元(約合151.05億人民幣)、11.37億美元(約合72.47億人民幣)。中藥材的出口以亞洲為主,占比約為85.7%,其中,日本排名第一,2019年全年出口約為2.4億美元(約合15.3億人民幣)。
既然中國的中藥材占到了漢方原料的83%,即可計算出2019年漢方原料總成本為18.36億人民幣(15.3億*1/0.83)。與日本國內醫療漢方制劑約合89億人民幣的產出相比,其附加值超過80億人民幣(89億-18.36億)。日本國土面積狹小,原材料和銷售市場兩頭在外,但作為工業強國,半個多世紀以來一直處于微笑曲線的上端,專司高附加值的加工生意。

此外,日本國內原材料價格高昂,2016年國內原料約3019日元/千克(約合166元/千克),來自中國的中藥材1570日元/千克(約合86元/千克),價格僅為本地產的1/2,漢方利潤因此更為豐厚。
而漢方制劑一面在外進口原料藥、銷往國外,一面像日本國內其他產品一樣為漢方制劑做好專利的保駕護航,廣撒專利網絡。10943張中國古方中,328張得到國際的認可,據《世界專利數據庫顯示》,僅有0.3%的中國古方在國際上申請了專利,可以說是少得可憐。
日本政府于1885年就建立了專利制度,早期僅對藥品制造進行專利保護,1976年擴大到對藥品進行專利保護,包含化學物質保護、化學物質的醫藥用途、藥用化學物質的制備方法、藥品的外觀設計、制藥機械、藥用植物及其提取物、生物制品、藥用植物提取物的組方,但不包括以原藥用植物為原料的中藥復方。
據不完全統計,日本漢方制劑的專利申請占比約70%,而據美國的專利數據統計,1976—2003 年日本在美申請專利達38項,占美國專利總申請的16.2%。
處方、非處方的細分是治療上的打法,但是產業上,能夠在國內、國際皆有數據上的依據就不僅僅是專利一項能夠左右的,產業背后的邏輯恐怕不能小覷。
04、尾聲
自1975年以來,雖然日本漢方制劑仍有需要遵循的古老法則,但早已邁進了現代醫學文明中。
從傳統醫學到現代醫學,有的地方是限制,如加拿大的全民醫保只有少數傳統醫學,一些傳統醫療僅能在私營醫療機構中看到身影;有的地方如韓國希望中草藥能夠融入現代醫學。
草藥這條賽道上不乏人群擁堵,有的還在奔跑,有的如德國早已完善,但如日本漢方,即便中途“斬斷手腳”數十年,也逐漸走到前列。
就算是擁有西方醫學奠基人希波克拉底的伯里克利時代,也并非一開始就知曉“體液學說”,草藥仍舊是醫治主要材料。即便當下槲寄生(一種草藥/毒藥)仍無法依據臨床的視角進一步佐證它的癌癥功效,但是當時它確實被證明具有藥效,甚至1917年伊塔·韋格曼首次在蘇黎世使用槲寄生來治療癌癥,使得槲寄生成了經證實并獲承認為癌癥治療輔助成分。
“植物藥與化藥等其他藥物成品并無不同”,這是德國1990年藥品法的補充條款。在此之前的1961年(注:至1990年兩德統一前皆指西德,即聯邦德國)德國就已將植物藥列入藥品法令中,此后數次修訂法律對草藥的質量、安全、效用進行標準性恒定。
148種醫療漢方制劑和294種日本漢方制劑是日本草藥成藥的精確數字。而國內據不完全統計,中藥材約5000余種,中藥制劑超5000種。國內中藥材雖然占據地理和歷史優勢,但是多數制劑不具名、不只其原理,而漢方制劑雖少,但精細化管理,能夠入藥或在市場流通,就早已在審批階段加蓋“紅印”。
也一如上文所說,德國的植物藥與現代醫學的融入算早,體系也清晰,日本的漢方發展不晚,但趨于完善。
作為中草藥的原料產地之一的中國。2021年政策似乎都在利好中醫藥的發展,市場似乎也在看好它的發展,那么研發、質量、審批、生產、成藥五步法跟上了嗎?
似乎還不好說。根據不多的數據記載,在國內中醫藥的藥品中沒有一款獲FDA審批上市。1998年,天士力的復方丹參滴丸正式以藥品身份通過美國FDA的I期臨床研究(IND)申請,20余年過去,這一流程尚停留在臨床III期階段。天士力出海20年,仍未結得果實。
當政策利好、股市叫賣,然而研發、質量等其他與其不匹配時,利好中醫藥能夠只看政策嗎?
或許它只是盤出的包漿,吹起的氣球,看到的只是外面的糖色,但一旦扎破了,就猶未可知了。
向后看漢方的歷史,向前看漢方的發展,或許能有些新的奇思妙想。
(作者系《財經》研究員)
制圖|劉曦然 李紫雅 張羽岐
-END -
參考資料【1】Integrated Report 2021
【2】世界衛生組織傳統醫學戰略2014-2023
【3】Drug Injury Compensation Plans. Johng·Fleming.
【4】日本漢方藥規范化、標準化的基本經驗及對中藥經典復方制劑產業發展的啟示 | 寫意報告. 同寫意. 2018
【5】王詩恒,劉劍鋒,秦培潔,董臻 & 黨迎迎.(2021).日本漢方藥產業管理現狀概況. 世界中醫藥(02),351-354. doi:
【6】孫昱.(2020).日本漢方制劑的品種情況及管理模式分析. 中國臨床藥理學雜志(08),1041-1048. doi:10.13699/j.cnki.1001-6821.2020.08.028.
【7】丁騰,李耿,張紅,彭修娟,黨艷妮,王樂 & 劉峰.(2018).日本漢方藥產業發展現狀分析及思考. 中國現代中藥(07),785-790. doi:10.13313/j.issn.1673-4890.20180609001.
【8】付非,陳爽,王瑩,殷文濤 & 馮波.(2018).國外傳統醫學與現代醫療體系融合的理論基礎與實踐. 中國農村衛生事業管理(03),309-311. doi:


