文|財健道 楊燕 張羽岐 李紫雅
編輯|楊中旭
3月17日晚,關于新冠最大的“風口”吹向哪里,消息終于落地。
MPP(日內瓦藥品專利池組織)當晚官宣了拿到輝瑞新冠口服特效藥專利權的35家企業,5家中國藥企名列其中。
這個消息是不是似曾相似?
一個多月前,默沙東特效藥的專利授權同樣是通過MPP發出,同樣是5家中國藥企拿到了授權。不過,只有復星醫藥(600196.SH)和上海迪賽諾成功實現“二次中標”。
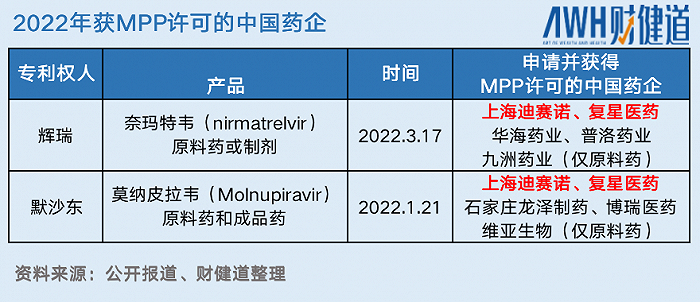
對藥企來說,拿到MPP的授權并不僅僅意味著可以“光明正大”的仿制專利未過期的原研藥,更是國際制藥巨頭對于公司質量生產、出海銷售的一種認可。
此外,專利授權還附帶一定的技術交接和支持,藥企不僅能拿到藥品售賣的真金白銀,還附帶一份“學霸”的獨家筆記。
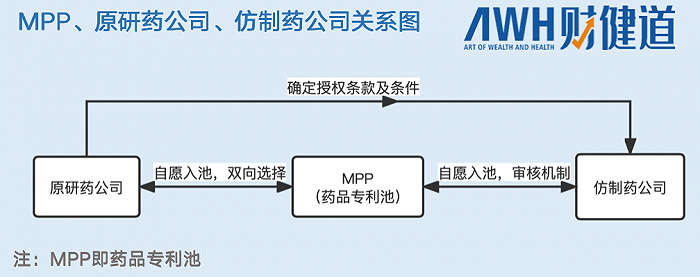
在原研藥-仿制藥-專利許可這一系列鏈條背后,MPP組織是不可或缺的組織方和協調者。
其官網顯示,截至目前,MPP已聯合10家藥企獲得18份原研藥的專利授權許可,向全球供應超過185億份藥品,節約近9.2億美元。
MPP到底是何方神圣?中國藥企能借著這艘大船向全球市場更進一步嗎?
01 5家中國藥企拿到“出海”船票后,拿到MPP的授權許可意味著什么?
眾所周知,原研藥上市之后往往會有5-10年的專利保護期,只有專利過期了,仿制藥企才能進行仿制,有些原研藥因為存在技術壁壘,即使專利過期,仿制藥也沒那么容易出來。
MPP的存在,是為了提升低等和中低收入國家患者高價原研藥的可及性,保障他們的生命健康權。獲得MPP授權之后,仿制藥企往往能直接跳過原研藥企的研發環節,直接進入生產環節。
與此同時,藥品價格必然也遠低于原研藥。近期輝瑞新冠特效藥Paxlovid公開了政府采購售價,單個療程約530美元,默沙東原研藥單個療程則在700美元左右,有業內人士分析稱,放開專利后,低收入國家單個療程花費或許不足原價的10%。
根據輝瑞與MPP的協議,95個中低收入國家,超過全球50%的人口有望享受這一低價藥品,這對疫情防控的重要意義不言而喻。
早在2018年,國家藥監局就與MPP簽署了《合作備忘錄》,通過MPP授權,為中國藥企生產的仿制藥搭上一座進入全球市場“橋梁”。備忘錄規定,在MPP提供準確的專利權屬信息前提下,將為MPP授權生產的藥品出具COPP(藥品注冊證)證書。
值得注意的是,這次輝瑞特效藥的MPP授權中,盡管中國5家藥企已獲得生產和銷售授權,但中國并不在輝瑞授權的銷售地區名單中,意味著這一低價藥品離我們還有一段距離。
國盛證券研報做了一個簡單的新冠特效藥市場測算:
以目前molnupiravir、paxlovid原研產品規劃在2022年內向歐美地區的供應量粗略計算,對應平均每6.64人可使用1劑新冠小分子藥物。
假設全球實際平均感染率與歐美地區統計感染率持平,而治療率為歐美地區的60%,則MPP授權供應國將在2022年共計應獲得新冠小分子3.73億劑;參考印度已披露仿制藥Molflu單療程費用(18.77美元),假定未來廣泛供應后新冠小分子仿制藥平均價格為13.14美元,且molnupiravir、paxlovid仿制產品市占率分別為25%、75%,則molnupiravir、paxlovid仿制藥對應市場空間分別為12.25億美元和36.75億美元。
在讓高價原研藥變成“廉價藥”的同時,MPP的授權許可同樣讓仿制藥企收獲了一份被全球"蓋章認定"的生產、原材料和出海銷售能力“合格證書”。而對于原研藥企而言,這同樣是其社會責任感的體現。
可以說是共贏的典型案例。
當然,根據約定條款,新冠大流行期結束后,輝瑞對低收入國家的銷售將保持免版稅,中低收入國家和中高收入國家對公共部門的銷售收取5%的特許權使用費,對私營部門銷售則收取10%的特許權使用費。
02 MPP的前世今生
確切來說,MPP不生產藥品,卻是原料藥、制劑、技術的“搬運工“。
它的歷史要從20多年前講起。
2002年,世界貿易組織(WTO)通過了《TRIPS協議》與《多哈宣言》,重申國際組織在各國公共健康中的積極作用,尤其是在中低收入國家的艾滋病等傳染病的防治中會起到關鍵作用。
昂貴的原研藥不能只是發達國家的“專屬品”,發展中國家也需要救助,需要“救命藥品”。此后一段時間,泰國、馬來西亞、巴西、南非等國對原研藥的專利保護進行強制許可(不經授權人同意,直接對尚在專利期的生產發明進行許可),規定生產或進口仿制藥品以應對艾滋病等傳染疾病帶來的全球公共衛生危機。
一時間,跨國藥企手足無措,如何能平衡政府強加的壓力呢?
2010年,藥品專利池(MedicinesPatentPool,MPP)在聯合國的支持下于瑞士日內瓦成立,作為一家非營利性的組織,它旨在使得全球公眾能夠在最短的時間獲得新藥。
但“功效”不止于此,MPP的成立使得跨國藥企得以喘息,原研藥廠家可以通過自愿原則決定是否將藥品專利放入池中,仿制藥企則通過MPP的一系列規定申請獲得專利池中的專利許可,生產并向全球中低收入國家銷售。
一面原研藥的自愿原則,一面是仿制藥的嚴苛申請,平衡由此而來。

成立的前五年,MPP致力于艾滋病/艾滋病毒領域,2015年以后,擴至丙型肝炎、結核病領域,近兩年隨著新冠疫情的爆發,MPP投入更多的“兵力”在新冠大流行中。
至今為止,已有13個專利持有人與MPP簽署協議,58家仿制藥制造商和產品開發商獲得MPP的許可,18種產品分布在100多個發展中國家,據2019年年度報告,140多個積極和正在進行的產品開發項目已向嚴格的監管機構(SRA)提交了72份HIV產品申報和16份丙型肝炎藥物申報。
3月15日,國家衛健委最新版的新冠診療方案第九版中,奈瑪特韋片/利托那韋片(Paxlovid)被寫入診療方案。
而就在輝瑞新冠藥MPP授權官宣消息確定的同一時間段里,2.12萬盒“奈瑪特韋/利托那韋片”(Paxlovid)經海關驗放后,被運往全國各地。《財健道》此前曾報道,中國醫藥(600056.SH)獲得其在中國大陸的代理權。
疫情之下,醫藥行業每一份變化都和時代的脈搏緊緊相扣。


