文|MedTrend醫趨勢
類器官,顧名思義是人體真實器官及生理系統的模擬,作為干細胞研究的重要成果之一,對于臨床精準醫療(為患者制定個體化治療方案)、臨床前藥物研發等有著非凡價值;因此也成為TOP藥企必須拿下的據點。
而在這一輝瑞、艾伯維、強生、羅氏、默沙東、諾華、BMS、賽諾菲、GSK、阿斯利康、武田制藥等全球TOP20藥企都在爭相布局的未來領域,已經有企業拔得頭籌。
近日,FDA批準了全球首個完全基于“類器官芯片”研究獲得臨床前數據的新藥(NCT04658472)進入臨床試驗。這一里程碑事件,意味著“類器官芯片”實驗首次取代了傳統動物實驗,并且正式被官方認可。
這項新藥實驗由賽諾菲和類器官芯片公司Hesperos合作進行,用于治療兩種罕見的自身免疫性脫髓鞘神經疾病,而在此之前,由于缺乏理想的動物模型,無法針對這些疾病開展研究。
至此,賽諾菲后來居上,雖不是第一個布局,但在“類器官”實踐領域超前全場。
如果該項目進展順利,或將徹底顛覆臨床開發的種種限制,改變全球藥物研發的游戲規則。
01 為什么美國、歐盟將“類器官芯片”技術提升到國家戰略高度?
全球有超過7000種罕見病沒有治療方法,其中只有約400種正在進行研究,很大原因就是缺乏模擬這些疾病的動物模型,腫瘤、心血管等重大疾病也面臨相同困局。
如果說有一項技術有望將新藥研發帶入“低風險、低投入、高回報”時代,那么“類器官芯片”或將是其中之一。
從“類器官”到“類器官芯片”
1907年,44歲的貝克羅萊那大學教授威爾遜發現,通過機械分離的海綿細胞可重新聚集并自組成為新的具有正常功能的海綿有機體,其研究結果于1910年發表,成為最早“類器官”的概念雛形。
此后,隨著干細胞技術的飛速發展為類器官研究帶來關鍵契機。2009年,荷蘭科學家Hans Clevers團隊成功將Lgr5+腸道干細胞在體外培養成具有隱窩狀和絨毛狀上皮區域的三維結構,誕生首個小腸類器官。
從2009年至今,3D類器官培養技術已成功培養出大部分具有部分關鍵生理結構和功能的類組織器官,包括:腎、肝、肺、腸、腦、心臟、前列腺、胰腺、視網膜等。并被《科學》雜志評為年度10大科學技術之一。
于此同時,另一項基于微流控技術的器官芯片技術,開始在芯片上研究復雜的細胞行為,構建三維人體器官。
類器官(Organoid)具有高仿真性,與人體器官有高度相似的組織學特征和功能;
器官芯片(Organ-on-a-Chip)在建模的可控性和標準化上具有優勢,且可實現更復雜模型的構建。
然而,他們都是由單一種類細胞構建的模型,對于生物學的系統仿生程度依然不夠。
2019年,Science雜志發表的綜述首次提出了類器官芯片概念。
類器官芯片(Organoids-on-chips)整合了類器官和器官芯片技術路線的優勢;在芯片上構建起器官生理微系統,再現相互依賴的器官功能,從而預測人體對藥物或外界不同刺激產生的反應。說明已幾乎是模擬完整的人體,而不是單個器官。

類器官芯片模擬人體生理微系統
“低風險、低投入”的新藥研發?美國、歐盟出臺扶持計劃
據統計,2021年開發一款新藥的平均成本降至近七年最低,仍高達約20億美元。此外,進入臨床開發階段的新藥失敗率仍近90%。
以上痛點,主要由于動物模型不足且動物模型并不能準確預測人體反應。
“類器官芯片”因為是直接利用人類組織構建,且可定制化為疾病建模;因此可以在臨床實驗前更充分的進行效價評估,將不合適的藥物排除,從而提升藥物研發成功率,降低后期藥物開發成本且不傷害動物。此外,類器官芯片疊加AI技術的融合也將使藥物篩選更高效、精準。
基于以上原因,2011年美國NIH、FDA和美國國防部牽頭推出“微生理系統” 計劃(MPS 計劃),首次把類器官芯片技術上升到國家戰略層面。
與此同時,歐盟也看好類器官芯片技術在新藥研發、精準醫療、AI制藥領域的發展前景,由其資助的大型研發聯盟(imSAVAR)目標之一就是與大型藥企合作開發器官芯片模型。
然而此后十年間,類器官芯片大多處于實驗室研究階段,真正在藥物研發上的臨床應用比較少。原因除了其技術壁壘高、涉及多學科交叉外,最大的“阻礙”仍在于缺乏法規的認可;如今這一“阻礙”已被清除。
02 全球市場:TOP20藥企均已直接入場
目前全球類器官芯片市場商業化主要來源于兩方面:設備銷售和測試服務;年復合增長率29%左右;美國市場占比最大約41%,歐洲約38%。
作為新藥研發的重要助力,類器官芯片公司的下游客戶主要包括CRO和藥企。
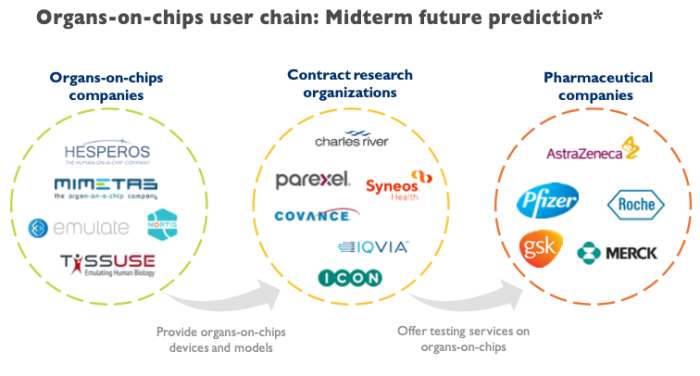
類器官芯片企業主要商業模式
類器官鼻祖Hans Clevers團隊成立的HubrechtOrganoid Technology(HUB)是全球首個類器官研發中心,而HUB通過技術授權也助力了Epistem、Cellesce、Crown Biosciences、STEMCELL Technologies等第一批類器官公司涌現。
此外,高校研究院成立的技術公司也是這一類器官芯片公司的主力,例如哈佛大學Wyss生物工程學院2013年成立的生物技術公司Emulate。
此前類器官芯片企業大多通過向CRO出售產品間接為藥企提供服務。2015年以后,越來越多的藥企通過購買產品、合作授權以及投資等形式直接入場,成為這一領域的另一股力量。
2015年,強生購買Emulate公司的血栓芯片,用于檢測其在已上市藥物或在研藥物中的促血凝特性。
2016年,默克、Seres Therapeutics等購買Emulate公司類器官芯片用于新藥研發測試。
2018年,阿斯利康與Emulate公司達成協議,將其類器官芯片技術結合到阿斯利康的IMED藥物安全實驗室中;阿斯利康也是首家將類器官芯片技術整合進內部實驗室的TOP藥企。
2018年5月,輝瑞與HUB合作開發人類腸道類器官平臺,用來研究克羅恩病、潰瘍性結腸炎等疾病。
2018年9月,由輝瑞領投的神經治療初創公司System1 Biosciences獲2500萬美元A輪融資,其自研大腦類器官,用于研發神經治療新方法。
2021年,賽諾菲與Hesperos合作,共同進行NCT04658472臨床前研究。
2022年1月,百時美施貴寶與Prellis 達成合作,基于其人體淋巴結類器官平臺創建針對人類蛋白質的高親和力人類抗體。
2022年3月,賽諾菲與Prellis達成合作,利用其平臺在體外重建免疫反應以提供具有顯著遺傳多樣性的抗體。
此外,由艾伯維、默克、諾華等20余家TOP藥企共同成立非營利組織IQ聯盟(Innovationand Quality Consortium),致力于推動類器官芯片的標準化應用,以加速藥物研發進程。目前已針對肝臟、腎臟、肺等模型發表一系列行業標準。
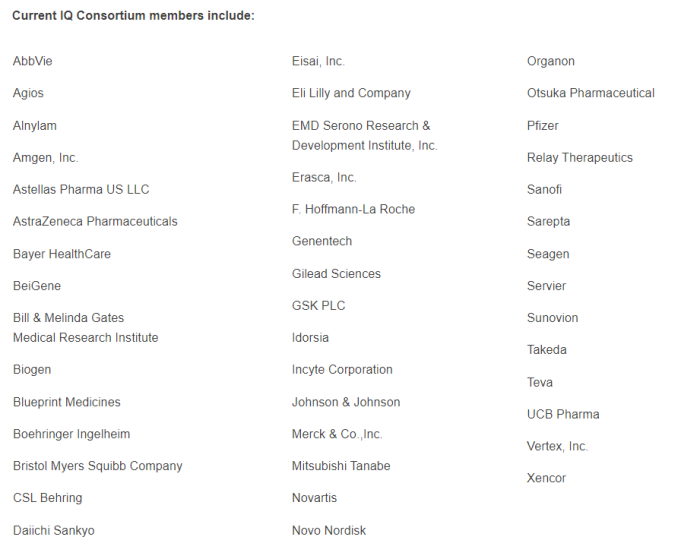
IQ聯盟成員藥企
03 中國市場:恒瑞、百濟;羅氏、默克已領先布局
從2021年起,中國正式從科研和監管層面系統性推進類器官芯片技術的發展。
2021年1月28日,科技部下發《關于對“十四五”國家重點研發計劃6個重點專項2021年度項目申報指南征求意見的通知》,把“基于類器官的惡性腫瘤疾病模型”列為“十四五”國家重點研發計劃中首批啟動重點專項任務。
2021年11月,中國CDE首次將類器官列入基因治療及細胞治療的驗證指南基因治療產品非臨床藥理學研究。
2022年7月,中國首個類器官指導腫瘤精準藥物治療的專家共識面世。
中國類器官芯片發展雖然比美國完了約十年,但是進步速度飛快。
中國科研積累的提升加速相關產業化進程。
2009-2019,在類器官技術相關領域來自于中國的發表文獻占8%,位于全球第6;到2020年,來自中國的發表文獻已達14%,僅次于美國,位于全球第2。
中國資本市場開始關注類器官企業。
從2019年開始,中國類器官企業開始贏得資本關注,紛紛完成天使輪融資,2021年完成A輪融資,
創芯國際完成近億元A輪融資,由趣道資產領投;
丹望醫療完成1.2億元A輪融資,由國方資本領投,德聯資本、昆侖資本跟投,并且類器官“鼻祖”Hans Clevers以聯合創始人和首席顧問科學家身份加盟;
大橡科技完成數千萬元的A輪融資,由鼎暉VGC(鼎暉創新與成長基金)領投,奇績創壇跟投,老股東藥明康德、復容投資及久友資本繼續跟投;
從藥企來看,中國研發“一哥”和曾經的研發“一哥”都已布局類器官相關領域。
百濟神州是IQ聯盟里唯一的中國藥企,2021年12月,其與創芯國際簽署戰略合作協議,共同建立類器官新藥研發技術平臺。
恒瑞醫藥的轉化醫學部門,建立了體外類器官培養(organoid culture),可以在模擬的人體器官及腫瘤微環境中進行藥物研究;
跨國藥企也將中國創新中心項目拓展至“類器官”相關領域。
2020年,默克中國創新中心開始探索創新“類器官”平臺。
羅氏中國藥物科學部門的重點項目之一是將人體模型系統(類器官和微生理系統)應用到藥物發現產品管線中。
隨著FDA此次里程碑式獲批,未來中國NMPA或也將實現以“類器官芯片”數據獲批新藥臨床試驗。第一個獲批的企業會是誰?



