文|未來跡FutureBeauty 雪巖
為貫徹落實《化妝品注冊備案管理辦法》,規范和指導化妝品新原料注冊與備案工作,國家藥監局制定了《化妝品新原料注冊備案資料管理規定》自2021年5月1日起施行。
新規推行對化妝品新原料管理,從原來的嚴管變為了備案管理制度,新原料在完成注冊備案工作之后即可投入使用,用市場的監督管理來驗證代替原本原料端嚴格準入式管理,讓整個新原料市場更有活力。
新規推行已經近2年的時間,依舊有許多化妝品原料企業對原料注冊的流程和其中一些具體操作仍然存在疑慮,在今年的PCHi上,來自中國食品藥品檢定研究院的袁歡對《化妝品新原料判定研究指導原則》起草背景進行深度解讀。
什么樣的原料需要作為新原料注冊管理?
據袁歡介紹,對收錄在《已使用化妝品原料目錄2021版》的原料,繼續實行目錄管理,對于具有防腐、防曬、著色、染發、祛斑美白功能的新原料需要注冊管理,而其他類型的新原料則采用備案管理。
當備案管理原料經過3年的監測期間,未發生安全問題之后,新原料將收錄到《已使用化妝品原料目錄》。在其中,新原料范圍進行明確劃定:
1、已經收錄于《已使用化妝品原料目錄2021版》的原料無需重新備案,但如果超過“最高歷史使用量”時,需要企業按照《化妝品安全評估技術導則》的程序要修證明其安全性。
2、已使用類別原料中的具體原料無需重新備案。例如目錄中已經收錄類別原料“膠原蛋白”,這意味著膠原蛋白這一類別的原料都無需重新注冊,企業無需也不能單獨注冊I型膠原、III型膠原這些具體的原料。
3、對于植物提取物一類的原料,無需單獨針對某一植物部位注冊,例如人參提取物代表人參全株及其提取物均為已使用原料,無需對人參根之類的具體部位重新注冊備案。
4、《化妝品安全技術規范》已規定禁用組分的原料也不可以作為新原料注冊,例如人的細胞、組織、人源產品、抗組胺藥物、激素物質。
5、實際功效超出化妝品定義范疇的原料也不能作為新原料注冊,例如“激活細胞”、“促進愈合”、“再生細胞”這類具有醫藥功效的成分,不能作為化妝品新原料注冊。
6、具有多種功能的新原料,需要按照風險程度最高的功能進行選擇,例如一些原料同時具有美白、保濕等多種功效,就必須按照美白原料的來注冊,不能因為特證化管理而選擇“避重就輕”。
新原料注冊流程是怎樣的?
化妝品新原料的注冊主要分為三大階段,第一階段為相關申報資料的準備期;第二階段則為部門的審批期,這一流程需要近100個工作日;第三階段則是新原料的安全監測期,當注冊完成之后,新原料即可投入使用,使用新原料的化妝品也可以注冊備案,新原料進入3年的安全監測。
根據新規,《未來跡Future Beauty》繪制了化妝品新原料的注冊流程圖。

在3年的安全監測期內,如果使用該原料的產品未發現安全性問題,該原料會被納入已使用原料目錄或安全技術規范。
但如果監測期間內,原料發現存在安全風險,企業需要暫停新原料使用,且同時暫停關聯產品的生產和進口。如果監測期內發現存在安全性問題,相關職能機構會直接撤銷新原料的注冊,關聯產品的注冊備案也將隨之取消。
新原料注冊時需要提供哪些資料?
新原料注冊的第一步就是資料提交,新規將新原料分為6大的情形、每種情形需要提交的申報資料有所區別,但所有新原料在注冊時都需要提交基本信息、研制報告、制備工藝及質量控制標準信息。各個情形的資料提交僅在安全性評估上有所區別。
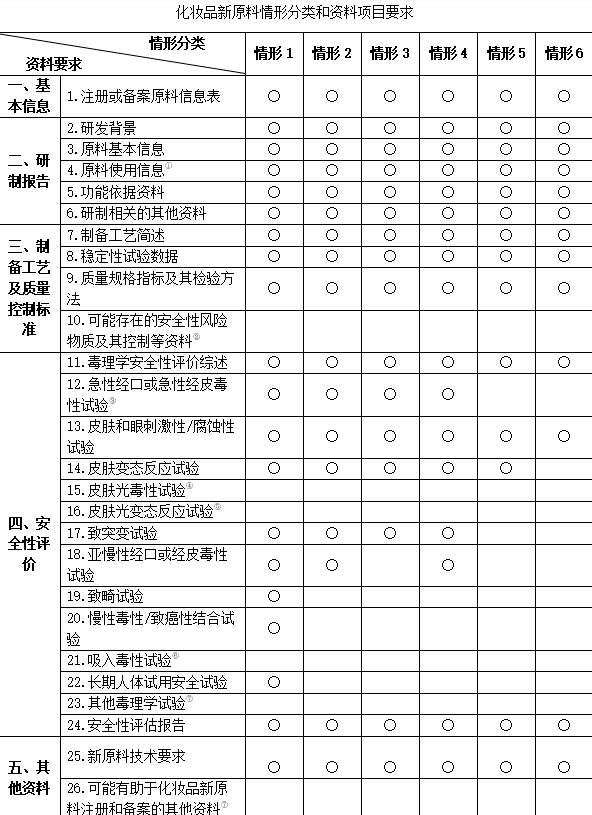

袁歡對各個情形的劃分、歸屬做出了詳細解釋:
國內首次使用于化妝品的原料:
情形1:具有防腐、防曬、著色、染發、祛斑美白、防脫、祛痘、抗皺(物理抗皺除外)、去屑、除臭功能及其他具有較高或許的原料,需要提供1-12項毒理學實驗資料。
情形2:不具備上述功能的新原料,只需要提交1-7項毒理學實驗資料。
原料在境外上市化妝品中已有3年以上安全使用歷史:
情形3:不具有防腐、防曬、著色、染發、祛斑美白、防脫、祛痘、抗皺(物理抗皺除外)、去屑、除臭功能的新原料,只需提交1-6項毒理學實驗資料。
情形4:具有防腐、防曬、著色、染發、祛斑美白、防脫、祛痘、抗皺(物理抗皺除外)、去屑、除臭功能的新原料,只需提交1-7項毒理學實驗資料。
情形5:具有安全食用歷史的化妝品新原料(原料所使用的部位應與食用部位一致),其中取得我國相關監督管理部門食品安全認證或其他相應資質的食品用原料、經國內外相關監督管理部門、技術機構或其他權威機構發布的可安全食用的原料,都可以視作符合情形5。
情形6:化學合成的由一種或一種以上結構單元,通過共價鍵連接,平均相對分子質量大于1000道爾頓,且相對分子質量小于1000道爾頓的低聚體含量少于10%,結構和性質穩定的聚合物(具有較高生物活性的原料除外)。
3年的監測期如何管理?
職能機構為新原料設置了3年的安全監測期,在這段時間內,新原料的注冊人、備案人需要每年向國務院藥品監督管理局報告新原料的使用和安全情況。
在這個過程中,新原料的注冊人、備案人必須建立安全風險監測和評估體系,對新原料的使用和安全情況持續監測評價。每年需要向管理機構提交使用和安全情況年度報告。
在沒滿一年的前30個工作日內,化妝品新原料注冊人、備案人需要輝總、分析新原料使用和安全情況,形成報告發送給國家藥品監督管理局。
需要注意的是,新原料的3年安全監測期從使用新原料的產品完成注冊備案第一天算起。
如果新原料在使用過程中出現安全問題,新原料的注冊人、備案人需要提供突發情況報告:
1、 新原料注冊人、備案人發現其他國家(地區)疑似與新原料相關的安全風險情況發生,應立即采取做事,并向技術審評機構報告。
2、 出現可能與化妝品新原料相關的化妝品不良反應或者安全問題時,化妝品注冊人、備案人應立即采取措施,并按照規定向屬地省局報告。
當然,在這個過程中,并非只有企業本身向相關部門提供主動監測的報告,相關職能部門也起到一定監督作用。技術審評機構會結合當前不良反應監測機構的化妝品年度不良反應統計分析結果進行評估。
新原料的注冊備案管理制度,降低了新原料的準入門檻,也將新原料的管理從事前管理轉移向事后管理。這個轉變讓更多的新原料涌入市場,也讓化妝品行業有了更多可能性。


