文|峰瑞資本
今天這篇報告要討論的是核藥,是與核醫學,也叫放射醫學相關的藥物。“核藥”的“核”并不是“核酸”的“核”,而是乍聽起來讓人有點恐懼的“核輻射”的“核”。萬物皆有正反兩面,“核”也能給身患癌癥的人們帶來希望。
2018,諾華子公司研發的核藥——Lutathera(177镥氧奧曲肽)獲得FDA批準,就是用于治療胰腺腫瘤。蘋果創始人喬布斯曾因為胰腺腫瘤逝世。除了胰腺腫瘤,前列腺癌、腦膜瘤、甲狀腺癌和淋巴瘤等腫瘤疾病也能通過核藥治療。
如果我們要從所有學科里面選出一個“交叉之王”,假如放射醫學排第二,可能沒有其他學科敢稱第一。
放射醫學是采用核技術來診斷、治療和研究疾病的一門新興學科,包含分子影像(PET-CT、診斷性核藥)、外放射治療(質子、重離子治療)、內放射治療(治療性核藥)。放射醫學幾乎涵蓋了物理、化學、生物、醫學、計算機等學科的知識,是現代科學技術與醫學相結合的產物。
近年來,核藥在腫瘤治療以及腦疾病診治領域逐步釋放出潛力,并在精準定量給藥、內放外放結合、診療一體等方面展現出獨特優勢,這些優勢是傳統藥物難以具備的。本篇報告重點聚焦治療性核藥,也會涉及部分分子影像和外放射治療的內容。
你將在本文看到:
不要拋開劑量談毒性,核輻射真的可怕嗎?
為什么現在是發展核藥的好時機?
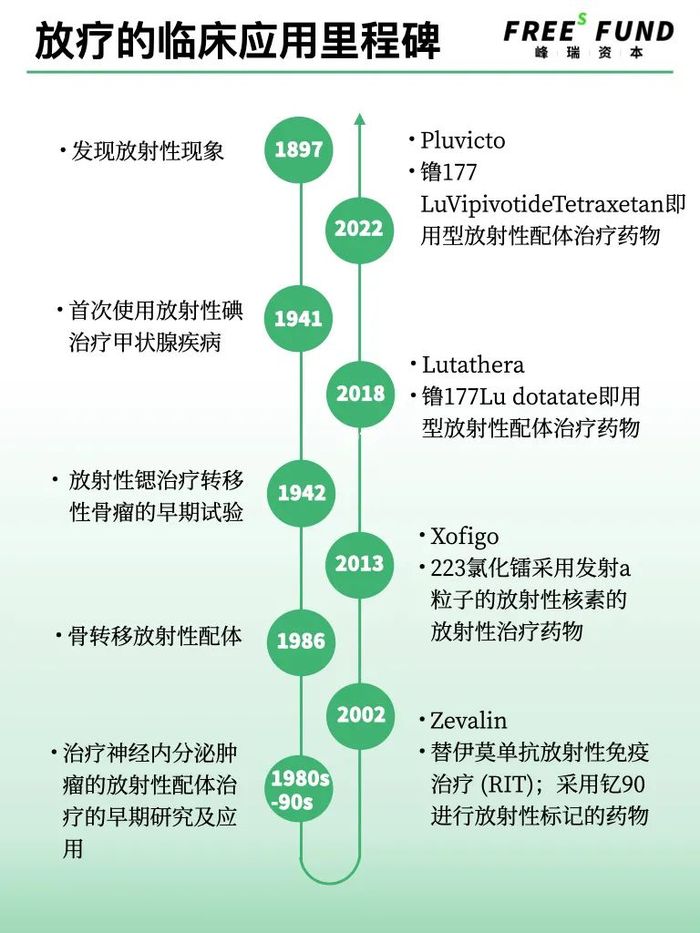
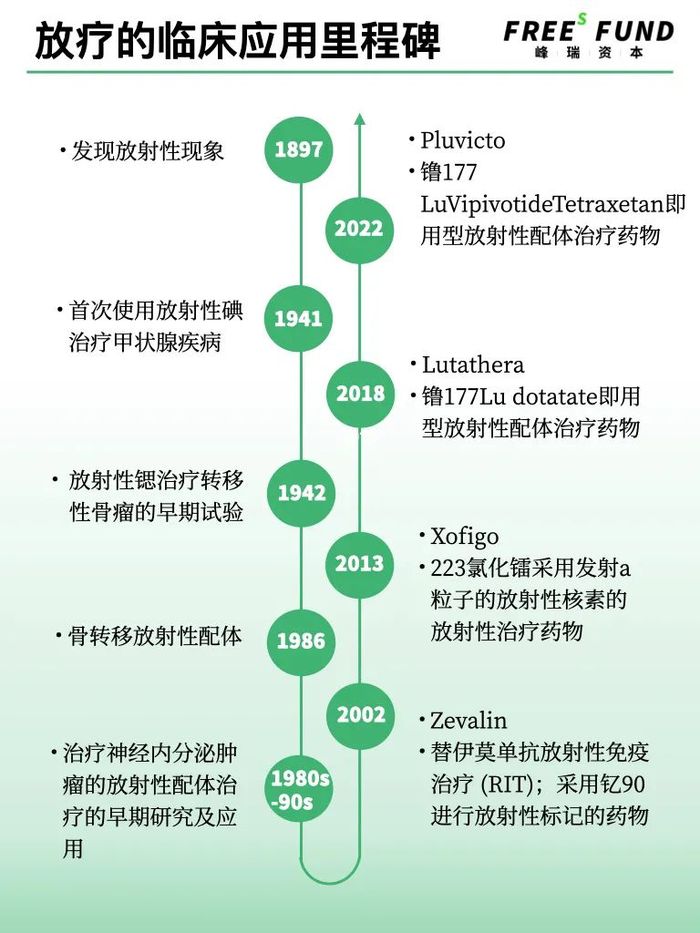
從1897年人類第一次發現放射性,核藥如何一步步發展到今天?
為什么之前核藥發展得并不快?
核藥在腫瘤治療中有哪些優勢?
什么是核藥設計的關鍵?
核藥如何做到定量給藥?
核醫學如何做到診療一體?
或許此刻,就是我們發展核藥的春天。

/ 01 /“談核色變”,不要拋開劑量談毒性
可能一提到“核”或者“輻射”,可能不少人會覺得對身體有害,想到核武器、廣島原子彈爆炸、切爾諾貝利核電站爆炸、福島核泄漏……
但其實在日常生活中,輻射難以避免。拋開劑量談毒性,可能并沒有太大意義。

很多食物也含有天然的放射性質,因為含量極其微小,實際上對人體是無害的。目前常用于表示輻射劑量的單位是Sv(希沃特/希佛),它代表了個人所受輻射照射的總傷害。
當你在吃香蕉(香蕉里面含有放射性鉀元素)、乘坐飛機出行、接受CT掃描等等,都會受到輻射。甚至當你身邊睡著一個人,輻射劑量也會增加0.05μSv。
根據國際原子能機構及我國《電離輻射防護與輻射源安全基本標準》給出的標準,公眾照射劑量限值為1mSv/年,單個組織或者器官50mSv。
相當于你一年乘坐500次以上飛機,所接受的輻射量才會超過安全限度。但在生活中要注意的是,經常做X光及CT,輻射量很容易超標。
在輻射劑量單位中,放射性強度、照射量都是物理維度的概念,當量劑量、有效劑量則是生物學和醫學的概念。我們重點講講當量劑量和有效劑量。
當量劑量:用來表示不同種類和能量的射線,對生物產生的不同影響。當量劑量單位名稱叫希沃特(Sievert),簡稱“希”,符號是“Sv”。實際應用中往往用mSv 、μSv、nSv。
有效劑量:用來表示人體不同組織或者器官對放射性照射的敏感程度。這個單位既考慮了射線種類,也考慮了器官組織權重因子的量。有效劑量單位的專門名稱也是希沃特(Sievert),符號是“Sv”。
明確了核輻射劑量單位之后,我們再來討論,讓公眾擔心的核事故究竟會帶來什么樣的影響?
我們仍然用精確的定量的視角來看這個問題。對于接觸到輻射的人群(例如原子彈爆炸幸存者或接受放射治療的患者)的流行病學研究表明,劑量超過100mSv,會大大增加罹患癌癥的風險。但對于兒童來說,即使是較低劑量(50-100mSv)也可能會提升癌癥風險。
挪威空氣研究院科學家曾經調查了福島核事故輻射泄漏的影響,研究發現,人們遭受的直接核輻射量較低。
全球大部分人所受到的輻射劑量約為0.1mSv,日本人受到的輻射劑量有0.5mSv,福島附近居民在事故發生3個月內受到的輻射劑量最高有1-5mSv。1-5mSv的劑量確實在安全范圍內,但這并不意味著可以把帶有核輻射的水隨意往海里排。
1986年,前蘇聯發生切爾諾貝利核事故。根據俄羅斯估計,清理核輻射污染物的人員接受到非常高劑量的輻射,從10mSv到1Sv不等,平均為120mSv,有85%的人員身體中放射性劑量在20-500mSv。從放射性劑量可以看出,切爾諾貝利核事故對身體影響很大。
2023年3月,《科學進展》雜志的一份研究顯示,學者對切爾諾貝利核電站附近生活的302只流浪狗進行研究。按道理來說,在強輻射下,這些狗是不可能生存下來的,結果在這三十多年間,他們不僅活了下來,還傳了15代。那核輻射如何影響了狗的DNA突變和遺傳?這是一個很好的研究課題。
/ 02 / 為什么現在是發展核藥的時機?
如今國內的核藥賽道火熱。中核旗下的同輻以及民營的東誠藥業之前就在核藥領域布局,成為核藥領域的兩大巨頭。
2022年9月,先通醫藥的镥177Lu氧奧曲肽注射液Ⅲ期臨床試驗,完成首例受試者入組。
2023年1月,恒瑞醫藥的镥177Lu氧奧曲肽注射液獲得藥物臨床試驗批準。
2023年2月,遠大醫藥全球創新放射性核素偶聯藥物TLX101中國IND申請獲受理。此外,不少創業公司也加入了核藥賽道。
國家也出臺了很多利好核藥發展的政策。2021年,國家原子能機構、科技部、公安部等八部委發布《醫用同位素中長期發展規劃(2021-2035年)》。2022年,國家藥品監督管理局藥品審評中心發布了《放射性藥品管理辦法(修訂)》。
國家還在核藥供應鏈端發力。2022年底,中核秦山啟動建設中國最大醫用同位素生產基地。中廣核在四川綿陽也建設了中能回旋加速器(這是一種粒子加速器,用于生產醫用同位素)。
核藥發展中最大的瓶頸就是核素的供應鏈,很多核素需要由反應堆生產。一個國家反應堆的多少,會直接影響核素供應。
放眼海外,法國是核電大國。跨國制藥公司諾華的放射性配體療法平臺,主要是通過收購法國創新藥上市公司Advanced Accelerator Applications(AAA),從而逐漸搭建起來的。我們也會在下文展開講述諾華在核藥領域的探索。
/ 03 / “超越宇宙年齡的浪漫”與漫長的核藥發展歷史
具體講核藥之前,先分享一些核物理知識。與核藥關聯最緊密的,是核物理中的放射性衰變這個知識點。元素的轉換分為聚變、裂變和衰變這三大類。核裂變主要用于原子彈制備,核裂變如今很“熱”,人們在研究如何利用可控核聚變帶來更多清潔能源。
而核藥則是利用了元素的衰變。衰變是指元素自發放射出α、β、γ這些粒子,從一個元素轉變成另外的元素。元素周期表中,幾乎所有元素都有放射性同位素。
衰變中有個概念叫半衰期,是指放射性核素的原子核衰變至原來數量的一半時,所需要的時間。不同元素的半衰期有長有短,短的可能只有幾微秒,甚至更短。
核素的半衰期短,意味著對核藥的生產、存儲、物流運輸提出了極高的要求。
中核集團曾經分享過核藥運輸的典型場景:“周六凌晨,放射性原料抵達首都機場,專業運輸車提前抵達機場,接貨后立即運送至生產部門進行生產。
根據相關要求,周六晚上11點后,運輸車輛可進入北京六環,核藥才能從生產基地發車運輸至機場、車站。運輸車輛接貨后,立即送至用藥醫院,以確保周一上午醫院能準時用藥。”
有一個冷知識,元素最長的半衰期能有多長?
Bi鉍元素的半衰期最長,甚至是宇宙年齡的10億倍。科學家曾認為鉍是穩定元素,不會衰變。后來才發現這個元素的半衰期太長,以至于很難被觀測到。所以人們表達愛意的時候,不一定都要用海枯石爛都不會變,也可以用Bi衰變了也不會變。
我們再來回顧一下核藥發展的歷史。
從1897年人類第一次發現放射性現象至今,已經過了百余年。
當人類發現放射性現象后,就在想如何將放射性用于治療疾病。1941年,人們首次將碘用于治療甲狀腺疾病。不同人體器官對于放射性物質的吸收程度不同,甲狀腺非常容易吸收碘。而另一種元素鍶容易富集在骨頭,因此被用于治療轉移性骨瘤。
核藥進入高速發展期,則要到2000年后。2002年,IDEC公司研發的Zevalin獲得FDA批準,這款藥用釔90進行放射性標記,治療復發難治性B細胞非霍奇金淋巴瘤。2013年,拜耳研發的核藥Xofigo上市, 于治療已擴散 骼的前列腺癌。
而讓核藥在制藥界引起轟動的則是諾華。
2018年,諾華子公司研發的Lutathera(177镥氧奧曲肽)獲得FDA批準,用于治療影響胰腺或胃腸道的一類癌癥,即神經內分泌腫瘤。
2022年,諾華研發的另一款藥物Pluvicto上市,該藥物被用于治療去勢抵抗性前列腺癌(mCPRC)。
在核藥發展歷程中,暫時沒有出現大的突破性的技術,引爆這個行業。但在漫長的年月中,核藥不停地迭代和整合式創新,發展至今。人們越來越意識到,核藥在腫瘤治療中的超級潛力。
/ 04 / 核藥在腫瘤治療中的優勢
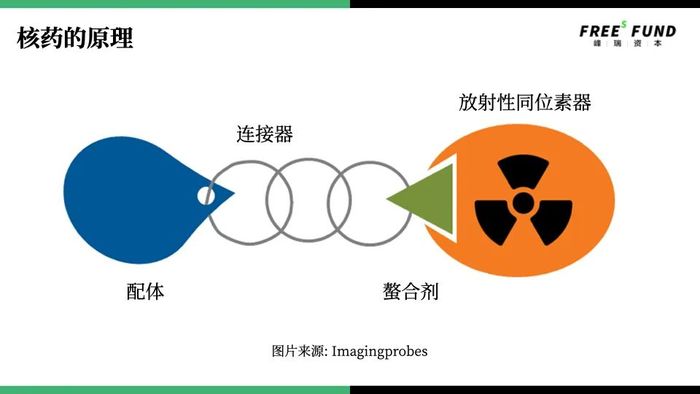
核藥的原理與如今風頭正盛的抗體偶聯藥物(ADC)的原理有相近之處。人們通過一個連接器(linker),將靶向的抗體(ligand)以及毒素()連在一起,形成ADC藥物。
ADC藥物成功之后,激發了人們探索“萬物偶聯”的熱情。人們在想如何利用偶聯技術,研發出新的藥物類型。
已經有創業公司在探索“萬物偶聯”,峰瑞已投企業迦進生物是國內首批從事小核酸偶聯藥物(Antibody-oligo conjugate,AOC)研發的生物科技公司,專注于以偶聯方式實現小核酸的肝外靶向遞送,是國內在這一細分領域的領先企業。
而核藥則是把毒素換成放射性核素,核素結合在螯合劑(Chelator)上,再經由連接器,和配體結合,針對靶向目標組織或者器官發揮藥效。核藥的配體可以是小分子、多肽或者抗體。
但與抗體偶聯藥物不同,人們不希望核藥在體內的半衰期過長,所以更多采用小分子和多肽做配體,縮短半衰期。
在核藥領域,諾華的Pluvicto已經成為醫藥市場里的“爆款”。2022年,Pluvicto的銷售額達到2.71億美元。諾華曾樂觀預計該藥的銷售額峰值將超過20億美金。

這款核藥究竟能起到什么作用?
我們來看一下臨床數據。檢驗藥效的最終標準是總生存時間(Overall Survival,簡稱OS,可以理解為從發病至死亡的時間)。
Pluvicto將患者的總生存時間,從用藥前的11.3個月變成15.3個月。雖然只延長了4個月,但對去勢抵抗性前列腺癌(mCPRC)這種目前接近于無藥可用的疾病,已經很有意義了。
在腫瘤治療領域,很多問題已經被解決了或者在被解決的路上,留下來的都是些“難啃的骨頭”,比如晚期、轉移、高復發、耐藥的腫瘤,還有一些特殊部位的腫瘤。
而去勢抵抗性前列腺癌就屬于這種難啃的骨頭。前列腺癌被稱為“老男人的癌癥”。
根據付振濤等學者的研究,50歲是前列腺癌發病的分水嶺,超過 50歲,前列腺癌的發病率開始飆升,而到了80歲,患前列腺癌的概率幾乎是30歲的5000倍。
WHO國際癌癥研究機構統計顯示,2020年,全球新發前列腺癌141.4萬例,發病率僅次于乳腺癌和肺癌,位于第3位。
但為什么很多人得了前列腺癌癥也沒有大礙?因為前列腺腫瘤生長得很慢,不少男士“帶瘤生存”,可能直到去世,也沒有意識到自己得了癌癥。
根據《Nature》等期刊公布的研究顯示,一些法醫給男性做尸檢時,會發現他們得了前列腺癌,60~74歲男性組的前列腺癌檢出率高達64%,明顯高于其他腫瘤同年齡組。
這種擴散慢也給治療帶來了困難。殺腫瘤的方法通常是化療,化療利用的就是細胞的快速增殖特性。但如果癌癥細胞在身體里潛伏不動,逐漸轉移到身體各個部位,就很難被殺死。
患者如果得了去勢抵抗性前列腺腫瘤(mCPRC),即使身體幾乎不產生雄激素,腫瘤和轉移瘤都會繼續生長。
核藥在前列腺癌癥治療中發揮了重要作用,它的殺瘤機理不同于化藥,是物理殺傷。核藥通過靶向貼近癌細胞,用α或β射線打斷DNA雙鏈,來殺傷細胞。
/ 05 / 核藥設計的關鍵:精確的平衡
核藥的設計和ADC藥物有很多相似之處,比如配體、連接器和核素的選擇都有很多講究。但核藥也有很多獨特性,比如,在配體的選擇上,ADC藥物都是用抗體,但核藥的配體包括小分子多肽、抗體、微球等多種形態。
抗體雖然容易被篩選到,有比較好的結合位點,但體積大且半衰期長,并會限制腫瘤的穿透,我們藥物設計肯定不希望放射性核素在體內游走一兩個月,把人的五臟六腑全部照射一遍,而是希望核藥在精準殺滅靶細胞后,盡快排出體外。
如果用抗體做靶頭,就需要通過工程化設計改造抗原結合域或者可結晶段,調節抗體PK(藥代動力學),獲得最優的組合。
目前核藥常用的配體是小分子或多肽。小分子和多肽由于分子量較小、血液半衰期較短,腫瘤穿透能力較強等優勢,但也存在一定的腎臟毒性。此外,小分子和多肽還難以篩選到高親和力、高特異性的分子。
同樣,核藥分子在體內不同組織器官的代謝情況非常關鍵。好的藥物設計希望能讓核素在病灶部位富集滯留,而在其他組織盡快代謝。

上面這張圖是諾華研發的核藥的分子結構圖,諾華就是采用小分子多肽來做配體。
/ 06 / 核藥如何做到個性化定量給藥?
在臨床治療中,不同患者對藥物的治療反應是有差異的,同樣的疾病,可能不同的病人會選用不同的治療藥物,或者即使選用了相同的藥物,劑量也不相同。
但一般藥物很難實現個體差異化給藥,所以上市藥物的最終優化劑量都是在安全窗內的最大公約數,而核藥因為是物理治療,所以臨床上可用對每個個體建模,理論上能實現個性化定量給藥,這是非常具有突破性的。
為什么核藥能實現個體化定量給藥?
核藥有放射性,可以和臨床上的PETCT(計算機斷層掃描)結合起來,對病灶靶區進行定量建模和數值計算。因為PETCT和核藥都是基于放射性的,所以CT對組織器官的放射吸收測量值是可以直接用于核藥劑量的定量計算。
在診斷前,通過核醫分子影像,可以查看人體的病灶分布。在診斷過程中,結合PETCT,對不同組織器官中放射性活度的分布及變化情況進行顯像定量。
再通過放射劑量學,研究各組織器官的放射性活度或吸收劑量,作為藥效學評價指標。而靶病灶的吸收劑量,可通過專業軟件(如OLINDA)中的數據模型計算出來。
當然要真正實現個性化的定量給藥,還需要進一步通過臨床積累大量的組織器官吸收代謝數據進行矯正,才能最終實現個性化精準給藥。
/ 07 / 為什么核藥發展受制于供應鏈?
除了選擇配體,核素本身也會對核藥產生至關重要的影響。
之前我們在講衰變時提到,某些原子的放射性衰變會生成另一種核種的原子,并釋放出α粒子、β粒子或微中子等粒子。
α、β這兩個粒子在能量和射程上有很大區別。α粒子能量非常高,但射程非常短,只有幾微米,差不多就是一兩個細胞的大小。β粒子的能量相對較低,射程相對較長,在毫米級別。
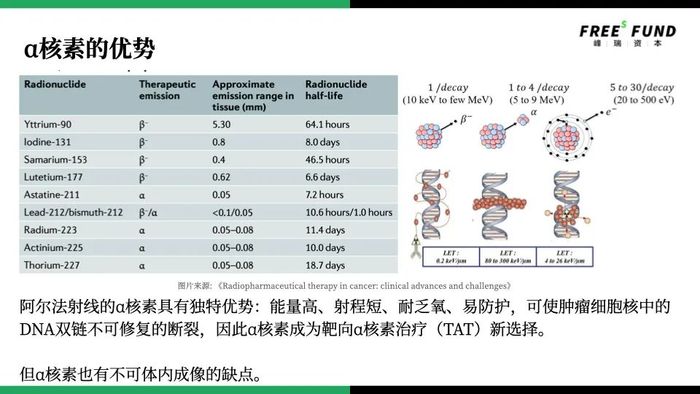
相較之下,α粒子更有潛力。
因為α粒子的作用距離非常短,可以避免誤傷其他組織。另外,α粒子的能量很高,一個α粒子可以把DNA的雙鏈全部打斷,但β粒子只能打斷單鏈。而細胞擁有自我修復能力,當單鏈被打斷后,細胞可以很快修復。
如果β粒子作為核素,就要有足夠的量,把DNA鏈打斷。α粒子也有劣勢,最大的劣勢在于,α粒子沒辦法在體內成像,因為它的射程太短了,很難被捕捉到,但目前也有解決的辦法。
兩類粒子的生產方式區別也很大。如果要生產α粒子,需要借助核反應堆,這給核藥的研發與生產帶來巨大困難,全球的核反應堆數量是很有限的。而生產β粒子,只需要用到加速器。
整體而言,核藥發展得并不快。核藥發展緩慢跟核素供應鏈受限有很大關系。元素周期表里面,數值比較大的、富含較多中子的元素,通常需要核反應堆,才能制備出核素。
全球范圍內的放射性核素依賴于極少數的研究用反應堆制備。這些研究用反應堆建堆時間久遠、維護成本高、年產量低,并且面臨廢物處置難的安全性問題。不少反應堆計劃于2025年前后關閉,將造成永久性減產。
/ 08 / 診療一體和內外放結合
講完核藥,我們再來講核分子影像。過去10多年,CT和PETCT高速發展,當這兩類技術與核藥結合起來,能夠展現出更全面的組織結構及分子生物學信息。
核藥可以通過同一個靶頭,搭載不同的核素,實現放射性核素顯像與內放射治療相結合。比如,諾華的Pluvicto(177Lu-PSMA-617)搭載68Ga鎵顯,從而示腫瘤在病人體內的分布,幫助醫生在術前全面分析病人的全身腫瘤負荷,術后進行監測和定量分析和評價。
核醫學除了作為分子影像虛擬活檢被廣泛應用于腫瘤,在神經生物學領域,也被做為診斷的金標準,如被用于診斷阿茲海默癥等,在臨床上,需要PETCT結合核醫學分子影像,來檢測和診斷各種腦疾病。
為什么核醫學分子影像被設定成神經生物學領域的金標準?
因為如果僅僅從定量的角度,你很難根據量,區分出正常人、輕度認知障礙以及阿茲海默癥患者。因為除了定量,還需要看腦組織結構和功能分布,比如大腦里的海馬體組織,輕度認知障礙以及阿茲海默癥患者的分布有很大區別。僅靠單分子的定量信息,不一定能掌握全面的信息。
核藥除了診療一體化的優勢之外,近幾年,在外照射領域,質子、重離子這些治療方法發展得很快,甚至還出現了生物引導放射治療這類突破性技術。
生物引導放射治療把PETCT、質子加速器完全整合起來。當你在進行PETCT檢測的時候,設備能夠實時顯影,告訴你腫瘤的位置,同時,還能夠用質子加速器,打出放射線,對腫瘤精準打擊。
質子加速器這類大型設備與核藥的同步發展,也讓內外照相結合的治療方案,越來越成為可能。未來,人們有可能用外照射解決大塊腫瘤,而用核藥殺傷小塊或游離的癌細胞。

/ 09 / 總結:核藥的優勢與面臨的挑戰

總結來看,為什么核藥變得越來越重要,它的優勢是什么?
核藥的核心優勢是精準治療,具體表現在:
第一,獨具特色的可視化診療一體。
比如我們剛剛提到的生物引導放射治療,檢測和治療的過程是一體的。
第二,實現個性化精準給藥。核藥可以根據患者在診斷的前、中、后階段,以及手術后,為患者提供定量、精確的評估和用藥。
第三,物理殺傷對耐藥、聯用有優勢。
核藥是對癌細胞進行物理殺傷,相比于傳統藥物,在耐藥性上有很大優勢。并且,核藥還能與化療、免疫療法聯用,因為這些療法的殺傷機理不一樣。
第四,內放、外放相結合。
對于一些癌癥晚期患者,可能他全身都分布著腫瘤細胞甚至是腫瘤塊,這種情況下,很難給病人動手術,用傳統的藥物也很難根治。這時,可以用外放的方式,用質子加速器把腫塊打爛,如果體內還有殘存的腫瘤細胞,可以再用核藥從內治療。臨床上也正在用這種內外結合的方式。
如今核藥還面臨不少挑戰:

第一,資質監管門檻高。放射性藥品的經營、運輸、進口、生產及使用等所有過程均有相關部門的嚴格管控,管理部門有藥監部門及國防科工委、交通部門、衛健委、海關等多部門管理。
第二,核素供應鏈緊張。由于國內醫用核素生產的反應堆匱乏,核素供應基本依賴進口。并且,核素有半衰期,過了半衰期后就無法使用。
第三,核藥人才供給不足。核藥屬于交叉學科,涉及方方面面的知識,但國內具有交叉學科背景和產業經驗的人才較少,國內最早活躍的核藥產業人才大多來自高校和醫院。
雖然發展核藥面臨重重挑戰,發展核藥是“正確而非容易的事”。核藥在腫瘤治療以及腦疾病診斷治療的潛力有目共睹,我們期待與更多致力于發展核藥的創業者相遇。


